Techniky
Následující kapitola se zabývá ozařovacími technikami. Hned v úvodu naleznete výklad jednotlivých frakcionačních režimů, následují konformní a speciální ozařovací techniky.
FRAKCIONACE
Zdroj: FELTL, David a Jakub CVEK. Klinická radiobiologie. Havlíčkův Brod: Tobiáš, 2008. ISBN 978-80-7311-103-8.
Biologický účinek IZ v tkáních závisí na dvou základních parametrech. Jednak na vlastnostech ozařované tkáně a také na parametrech ozařovací série. Ty jsou dány zejména velikostí jednotlivé dávky, výší celkové dávky, časem ozařovací série a počtem frakcí. Jednotlivé parametry spolu s ozařovací technikou, druhem záření a jeho energií jsou na sobě závislé.
TERMINOLOGIE FRAKCIONACE:
Normofrakcionace: ozařování jednou denně 5 dnů v týdnu.
Hypofrakcionace: ozařování jednou denně 1 – 4x týdně.
Hyperfrakcionace: ozáření více než 1x denně (zpravidla 2x) s alespoň 6 hodinovým odstupem.
Protrakce: prodloužení celkové ozařovací doby.
Akcelerace: zkrácení celkové ozařovací doby.
Hypofrakcionace a hyperfrakcionace pracují s počtem frakcí, ale bez časového režimu, protrakce a akcelerace pracují s časovým faktorem.
Různé tkáně reagují různě na frakcionační režimy:
tkáně RYCHLE reagující na záření
- rychlá buněčná proliferace
- rychlá regenerační odpověď
- rychle rostoucí nádory, nádory a tkáně s dobře reoxygenující nádorovou tkání
- sliznice, pokožka, hematopoetická tkáň, zárodečné buňky
tkáně POMALU reagující na záření
- pomalá buněčná proliferace
- nádory nereoxygenující nebo radiorezistentní s velkým raménkem na křivce přežití pojivová tkáň
Znalost chování různých tkání (nádorů) umožňuje volit různá frakcionační schémata.
Zásahové teorie
JEDNOZÁSAHOVÁ = každý zásah je pro buňku letální (záření o vysokém L – neutrony)
MNOHOZÁSAHOVÁ = došlo ke smrti buňky (gama záření)zásahové centrum musí být zasaženo n-krát, nebo je center více a musí být zasaženo každé z nich, aby
Subletální poškození
Rozdělíme-li dávku záření do více frakcí, nedojde k okamžité smrti buňky, ale jen k subletálnímu poškození, v mezidobí mezi frakcemi může docházet k reparacím.
Biologický účinek ionizujícího záření v tkáních ovlivňují
1) vlastnosti ozařované tkáně
2) parametry ozařovací série
- velikost jednotlivé dávky
- výše celkové dávky
- čas ozařovací série
- počet frakcí radioterapie
- druh a energii záření
- ozařovací technice
NORMOFRAKCIONACE
princip: standardní typ ozařování 5×2 Gy týdně
výhody: vyváženost efektu a nežádoucích účinků, ohleduplnost vůči personálu (volné víkendy)
nevýhody: neúčinné u některých typů nádorů, u paliativní léčby zbytečně intenzivní a časově náročná, proto existují různé alternativní frakcionační režimy
V určitých případech lze za normofrakcionaci považovat i denní dávku 1,8 Gy, která snižuje akutní morbiditu; u některých indikací (např. adjuvantní radioterapie pánve) ji lze považovat za rovnocennou dávce 2 Gy na frakci. V současné době se setkáváme i s denní dávkou 3 Gy na frakci.
využití: nejčastější použití, v radiobiologii slouží jako referenční režim.
HYPOFRAKCIONACE
princip: ozáření nižším počtem frakcí než 5x týdně (ob den, 2x týdně nebo 1x týdně), protože zmenšíme týdenní počet frakcí, je k dosažení léčebného efektu nutné zvýšit jednotlivou dávku.
výhody: malý počet frakcí
nevýhody: vysoká jednotlivá dávka
využití: paliativní léčba, brachyterapie s vysokým dávkovým příkonem
PALIATIVNÍ HYPOFRAKCIONACE
princip: výhodná jen pro paliativní léčbu
výhody: vysoká jednotlivá dávky umožní relativně rychlý nástup účinku, ústup bolesti, dušnosti, zastavení krvácení apod.
- nižší týdenní i celkový počet frakcí je ohleduplný pro pacienta
- nižší celková dávka nevadí, protože smyslem paliace není vyléčení, ale zmírnění obtíží, tím odpadá nutnost redukce cílového objemu a vysoké riziko pozdní toxicity
využití: paliativní radioterapie lokálně pokročilého karcinomu plic, 8 Gy 1x týdně, 2 frakce, paliativní radioterapie exulcerovaného karcinomu prsu 5 Gy 3x týdně, 6 frakcí
Hypofrakcionace není v kurativní teleradioterapii standardním postupem!
HYPOFRAKCIONACE U HDR BRACHYTERAPIE
princip: ozáření malých cílových objemů z bezprostřední vzdálenosti vzhledem k malým objemům snižujeme riziko rozsáhlých pozdních změn
při užití HDR (vysoký dávkový příkon) je nutné léčbu frakcionovat na rozdíl od užití LDR (nízký dávkový příkon) – kontinuální podávání, hypofrakcionace je pro to nejvhodnější
využití: kombinovaná teleterapie a brachyterapie u karcinomu děložního čípku
- fáze: teleterapie pánve 40 Gy normofrakcionací
- fáze: HDR brachyterapie 4×6,5 Gy 1x týdně
- fáze: teleterapie pánve s centrálním vykrytím rizikových orgánů (konečník
a močový měchýř) 7×2 Gy normofrakcionací
HYPERFRAKCIONACE
princip: aplikace více než 5 frakcí týdně, obvykle 2x denně s časovým odstupem min. 6 hodin, aby se pozdně reagující tkáně měly čas regenerovat; celková doba ozařování je stejná, redukujeme jednotlivou dávku např. 2×1,15 Gy/den, 70 frakcí, 80,5 Gy/7 týdnů ekvivalentní denní dávka pro hyperfrakcionaci je 2,6 Gy!
výhody: vyšší počet frakcí, výhoda hlavně u radioresistentnějších nádorů (vyšší počet „zásahů“ vyvolá větší stupeň poškození), možnost aplikace vysoké celkové dávky nízká pozdní morbidita, protože závisí na výšce jednotlivé dávky a ta je nižší
nevýhody: vyšší akutní morbidita, proto se snažíme o redukci ozařovaného objemu
využití: klasická hyperfrakcionace je užívána zřídka, větší počet denních frakci se však užívá běžně u akcelerovaných režimů, pracujících s časovým faktorem, proto je nelze označit jako hyperfrakcionační
PROTRAHOVANÁ RADIOTERAPIE
princip: protrakce pracuje s časovým faktorem, oproti normofrakcionaci se doba léčby prodlužuje s nižší jednotlivou dávkou.
neexistuje zhoubný nádor, u něhož by protrahovaná frakcionace byla výhodná jako kurativní metoda, cílem je především šetrnost ke zdravým tkáním, redukce akutní toxicity.
využití: ozáření rozsáhlých cílových objemů nebo extrémně radiosenzitivních orgánů (kurativní ozáření celé dutiny břišní u karcinomu vaječníku, paliativní ozáření sleziny u hematologických onemocnění).
AKCELEROVANÉ FRAKCIONAČNÍ REŽIMY
princip: akcelerace pracuje s časovým faktorem, oproti normofrakcionaci se doba léčby zkracuje, stejná dávka aplikovaná za kratší čas má vyšší biologický účinek. Nádory s vysokou závislostí na čase vykazují během normofrakcionované radioterapie akcelerovanou repopulaci nádorových buněk ve 3. týdnu léčby, tyto buňky se pak nepodaří radioterapií zlikvidovat.
Akcelerovaná radioterapie má za úkol zabránit akcelerované repopulaci, nebo ji alespoň podstatně omezit a zlepšit tak lokální kontrolu.
výhody: snížení repopulace nádorových buněk.
nevýhody: vyšší radiační morbidita, proto se tato schémata užívají výhradně
u kurativních postupů!
NORMOFRAKCIONOVANÁ AKCELERACE
princip: prosté zvýšení jednotlivé dávky při zachování normofrakcionace
výhody: komfort pro pacienta a personál, protože jde jen o nepatrné zvýšení ozařovacího času
nevýhody: pozdní toxicita, proto je nutná redukce ozařovaného objemu, což snižuje možnost využití, protože zvyšuje možnost vzniku lokálních recidiv
využití: ozáření nemalobuněčného plicního karcinomu, kde lze bez větších obav redukovat cílový objem a ozařovat jen makroskopickou chorobu (nádor
a zvětšené uzliny) vzhledem k předchozí a následné léčbě chemoterapií, 28×2,68 Gy, 75 Gy/5,5 týdne, pooperační ozáření u nádoru prsu, primární důvod není radiobiologický, ale provozní, nehrozí poškození žádného kritického orgánu, pacientce a personálu se ušetří 2 týdny, 15×2,66 Gy, 40 Gy/3 týdny
HYPERFRAKCIONOVANÁ AKCELERACE
princip: problém vysoké jednotlivé dávky u normofrakcionované akcelerace lze obejít tím, že vysokou denní dávku rozdělíme na dvě menší, celková denní dávka je pak vyšší než u klasické hyperfrakcionace (2×1,5 Gy, 3 Gy oproti 2,3 Gy)
využití: hlavní indikací je kurativní léčba limitovaného stadia malobuněčného plicního karcinomu v kombinaci s chemoterapií 30×1,5 Gy, 2x denně, 45 Gy/3 týdny
KONKOMINANTNÍ BOOST
princip: 2 ozáření denně s vyšší dávkou než u hyperfrakcionace
Ozáření 2 různých objemů: První frakce je aplikována základní cílový objem, 2. frakce na makroskopický tumor. Cílový objem na 2. frakci je podstatně menší než u 1. frakce, čímž se toxicita mírně snižuje
výhody: lepší výsledky při léčbě nádorů s klinicky prokázanou závislostí na časovém faktoru
nevýhody: vyšší akutní toxicita
využití: doménou této metody je ozařování nádorů hlavy a krku, které mají nejvyšší klinicky prokázanou závislost na časovém faktoru.
KONFORMNÍ OZAŘOVACÍ TECHNIKY
Zdroj: BINAROVÁ, Andrea. Radioterapie. Ostrava: Ostravská univerzita v Ostravě, Fakulta zdravotnických studií, 2010. ISBN 978-80-7368-701-4.
Přednášky Ing. Halfarové (Nemocnice Na Bulovce)
Ozařovací techniky
Ozařovací techniky obecně rozdělujeme podle počtu a uspořádání polí. Zkušenosti a znalosti jednotlivých ozařovacích technik radiačního fyzika a lékaře nám pomáhají k určení nejvhodnější ozařovací techniky pro dané uložení nádorového ložiska. Při výběru ozařovací techniky by se nemělo zapomínat na celkový stav pacienta, a na co nejrovnoměrnější rozložení dávky v ozařovaném objemu za maximálního šetření okolních zdravých tkání.
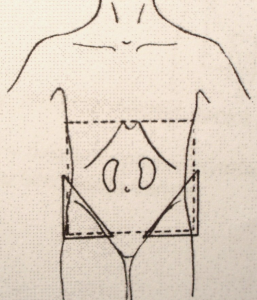
Ozařování pomocí jednoho pole
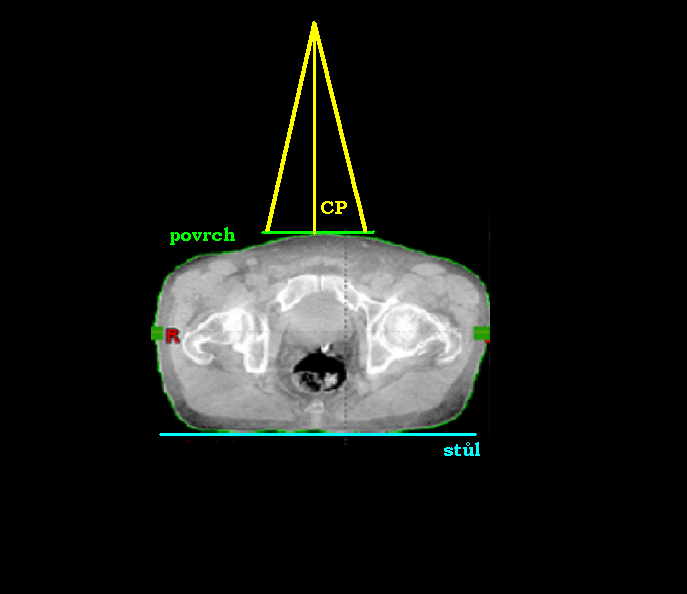
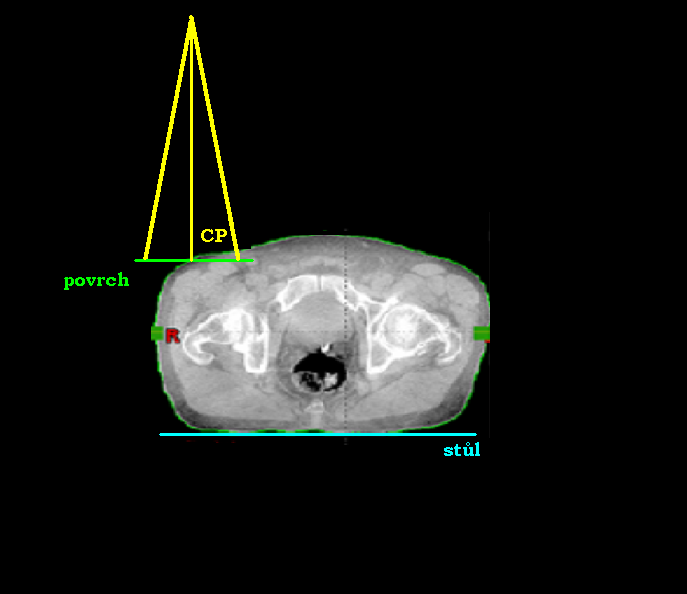
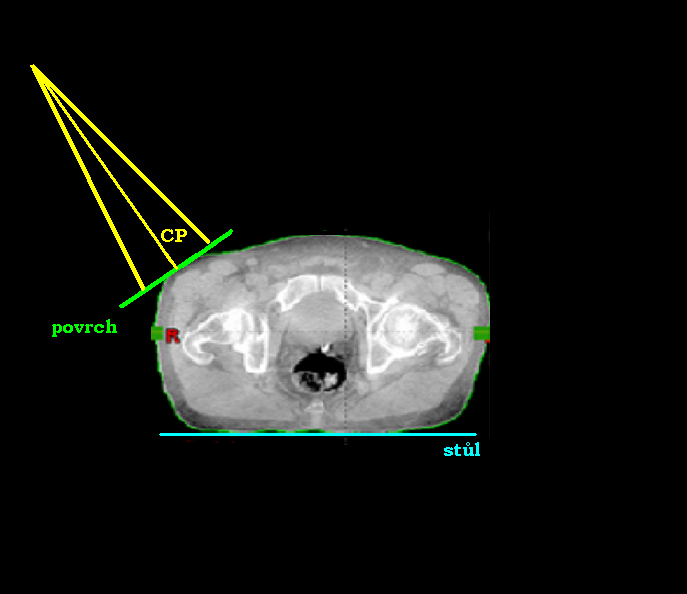
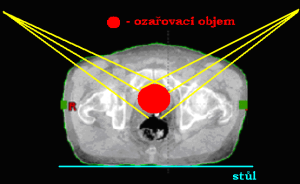
Při volbě ozařování pomocí jednoho pole může být centrální paprsek:
- kolmo k povrchu těla pacienta a zároveň kolmo ke stolu
- kolmo ke stolu a s povrchem těla pacienta svírat úhel
- kolmo k povrchu těla pacienta a se stolem svírat úhel
- Centrální paprsek jde kolmo k povrchu těla pacienta a zároveň kolmo ke stolu.
- Centrální paprsek jde kolmo ke stolu a s povrchem těla pacienta svírá úhel.
- Centrální paprsek jde kolmo k povrchu těla pacienta a se stolem svírá úhel.
Využití ozařování jedním polem:
Maligní léze kůže a podkoží (basaliom, spinaliom, malenom, Kaposiho sarcom, aj.): U těchto nádorů hraje důležitou úlohu pro volbu ozařovací techniky a energie záření jejich uložení. U povrchově a blízko uložených ozařovacích objemů volíme elektronové svazky lineárního urychlovače, při kterých používáme elektronové tubusy. Správným polohováním pacienta či sklonem ramene ozařovače docílíme, aby centrální paprsek dopadal kolmo k povrchu cílového objemu. Pro vytvarování nepravidelného pole používáme individuální vložku a pro dosažení vyšší povrchové dávky přikládáme na povrch kůže (popřípadě do individuální vložky) bolus vyrobený z vosku. U hlouběji uložených objemů se volí ozařování jednoho přímého pole rentgenovou terapií (nebo Cs ozařovač).
Hodgkinova nemoc (postižení unilaterální krčních a ingvinální, dále supraklavikulárníchí, axilárních uzliny) Pro toto ozařování volíme brzdné záření lineárních urychlovačů.
Paliativní radioterapie (metastázy skeletu, mozku, aj.) Paliativní ozařování se provádí brzdnými svazky lineárního urychlovače (popř. Co zářičem). K zajištění polohy pacienta používáme fixační pomůcky a volíme supinační polohu pacienta, je-li této polohy schopen.
Nenádorová radioterapie (degenerativní kloubní onemocnění – gonartróza, coxartróza, omartróza a úponů šlach – tendosynovitidy, keloidy, heterotopická osifikace, povrchové tromboflebitidy, aj.) Pro nenádorové ozařování se nejčastěji používá rentgenová terapie či elektronové svazky (popř. Cs zářič či brzdné svazky lineárního urychlovače). Cílem protizánětlivé terapie je snížení bolestivosti a zlepšení hybnosti např. kloubů, protože nízké dávky záření mají protizánětlivý účinek. Volí se nejčastěji technika přímého pole a dle potřeby lze individuálně upravit tvar ozařovaného pole.
Pooperační radioterapie Jde o dosycení jizvy (po ablaci prsu, exstirpaci nádoru příušní či štítné žlázy) elektronovými svazky. Ozařované pole lze individuálně tvarovat. Technika jednoho pole se také velmi často používá spolu s kombinacemi 2 tangenciálních či protilehlých laterolaterálních bočných polí pro ozáření nadkličkové oblasti (u nádoru orofaryngu, hypofaryngu, hrtanu, jícnu, prsu, aj.) či jiných zájmových oblastí (např. u nádorů maxilární dutiny, kde se vykrývá čočka, rohovka a slzné žlázy oka). Lze ji také aplikovat při ozařování kraniospinální osy.
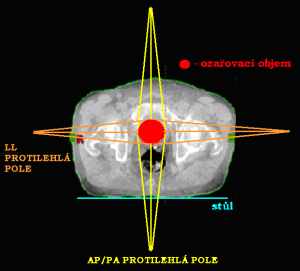
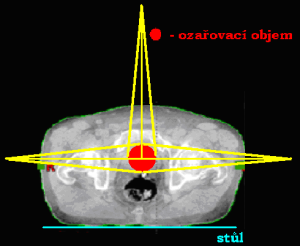
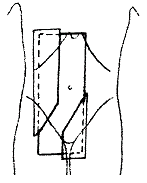
Ozařování pomocí dvou polí
Podle vzájemného postavení můžeme techniku využívající dvě pole dále rozdělit:
Dvě protilehlá pole (kontralaterální)
Jednotlivá pole jsou k sobě postaveny tak, že centrální paprsek (CP) obou polí leží na stejné ose. Podle toho, odkud centrální paprsky vstupují do organismu, je dělíme na:
- 2 protilehlá předozadní a zadopřední pole (AP/PA)
- 2 protilehlá laterolaterální bočná pole (LL)
Při tomto způsobu ozařování je také nejnižší celková – objemová (integrální) absorbovaná dávka záření organismem. Zatížení vstupního pole je zvýšeno o výstupní dávku pole protilehlého. Průběh izodóz 2 protilehlých polí závisí na velikosti pole, energii záření, velikosti OK a lze jej ovlivňovat i různým váhovým zatížením ozařovaných polí.
Použití: – u velkoobjemového ozařování;
– u malých prozařovaných objemů (malá vzdálenost polí, kdy může být celý objem homogenně prozářen; při zvětšující se vzdálenosti stoupá dávka pod povrchem; čím bude menší, tím příspěvek z protilehlého pole na výstupní dávce bude větší);
– u lokoregionálního ozáření (nádor + lymfatické uzliny ležící pod povrchem).
Zvláštním typem techniky 2 protilehlých polí je ozařování ze
2 kontralaterálních polí o nestejné velikosti, které se také v praxi používá. Daleko častěji se však využívá technika postupného zmenšování ozařovaných polí tzv. SCHRINKING technika (nádory plic, mozku, krku, pánve, při paliativním ozařování hrudníku).
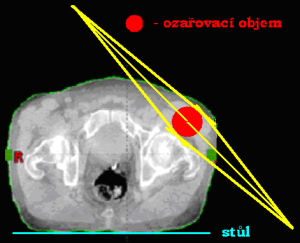
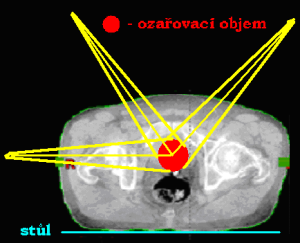
Dvě konvergentní (sbíhavá) a divergentní pole
Při této technice svírají centrální paprsky ozařovacích svazků určitý úhel (vstupy a výstupy jednotl. polí se nesčítají). Čím je větší úhel, tím blíže k průsečíku CP je maximální dávka a naopak. Využívá se při ozařování cílového objemu, který lze ozařovat pouze z jedné strany (příušní žlázy, močový měchýř) nebo pokud chceme šetřit kritické orgány ležící v těsné blízkosti ložiska (šetření míchy při ozařování nádoru hrtanu či těla obratle). Abychom se vyhnuli maximu dávky mimo průsečíky CP, je nutné použít klínových filtrů (používají se i u ostatních ozařovacích technik). Díky klínovým filtrům docílíme homogennějšího ozáření cílového objemu či změny izodózního plánu se zaměřením ušetření kritických orgánů.
Nevýhodou je vznik vysoké maximální dávky v tzv. „horkém bodě“ (hot spot), který nikdy neleží na průsečíků centrálních paprsků – nebezpečí předávkování mimo cílový objem (zdravá tkáň by byla ozářena více než ozařovaná oblast) → centrální paprskem míříme pod nádorové ložisko.
Dvě tangenciální (tečná) pole
Jde o techniku 2 protilehlých polí (popř. mírně konvergentní nebo divergentní pole) procházející částí objemu tvaru blízkému kouli (např. hlava) či válce (např. hrudník) se snahou uchránit před ozářením hlouběji uložené struktury. Tato technika se charakterizuje velmi šikmým vstupem CP do ozařovaného objemu. K homogenizaci dávky v ozařovaném objemu užíváme klínových a kompenzačních filtrů. Použití: ca mamae či hrudníku po ablaci prsu s cílem chránit plíce a srdce a nádorová ložiska v plochých kostech lebky (snaha chránit zdravou mozková tkáň).
Využití dvou ozařovacích polí v radioterapii
Kurativní a paliativní terapie nádorů hlavy a krku: (nádory maxilární dutiny, orofaryngu, hypofaryngu, hrtanu, hlasivek, subglotické oblasti, slinných žláz, štítné žlázy, aj.)
U nádorů krku nejčastěji nejprve volíme techniky 2 protilehlých laterolaterálních polí s klíny či 2 konvergentních (divergentních) polí s klíny. Kritickým orgánem v této oblasti je mícha. Jsou-li postihnuté lymfatické uzliny v krční oblasti, využíváme techniky 2 protilehlých laterolaterálních polí v kombinaci s přímým polem na nadkličkovou oblast.
Zhoubné nádory GIT (nádory jícnu, žaludku, anu, žlučníku či žlučových cest)
Ozařovací techniku u karcinomů jícnu volíme dle anatomické sublokalizace. Horní třetinu jícnu ozařujeme pomocí 2 protilehlých předozadních polí nebo
2 protilehlých laterálních polí s kombinací jednoho přímého pole na oblast nadkličkových lymfatických uzlin. 2 konvergentní (divergentní) pole aplikujeme při nádorovém postižení střední a dolní třetiny jícnu. Nádory žaludku, žlučníku či žlučových cest a anu ozařujeme technikou 2 protilehlých předozadních polí. Plánovací objem má velmi často nepravidelný tvar, který vytvarujeme vykrývacími bloky či MLC. Kritickými orgány jsou ledviny a mícha, proto je vhodné v průběhu ozařování změnit techniku (aplikace 2 konvergentních polí) z důvodu šetření těchto orgánů.
Bronchogenní nádory (karcinomy plic)
Pokud karcinom v plicích představuje formu „velkého objemu“, volíme ozařovací techniku dvou protilehlých AP polí s individuálním vykrytím. Je-li karcinom „malého objemu“, volíme takovou techniku ozařování, která je zaměřena na oblast primárního nádoru a postižených lymfatických uzlin, a která maximálně šetří míchu a zdravou plíci.
Nádory prsu
U karcinomů prsou, a pokud jsou postiženy i regionální axilární a nadklíčkové uzliny, se nejčastěji aplikuje technika 2 tangenciálních polí – tečných k plicní tkáni. Pro homogenizaci dávky v cílovém objemu používáme klíny. Nepravidelný tvar pole získáme díky vykrývacím blokům či MLC.
Gynekologické nádory (nádory vulvy, pochvy, děložního čípku, těla dělohy)
Ozařujeme technikou 2 protilehlých předozadních polí, kdy jednotlivá pole mohu být nestejně váhově zatížená. V této zájmové oblasti jsou kritickými orgány rectum a močový měchýř, proto se velmi často používají vykrývací bloky či MLC.
Maligní nádory mužských pohlavních orgánů (karcinomy penisu, varlat – seminom)
Tyto nádory ozařujeme technikou 2 protilehlých AP polí. Při ozařování seminomů aplikujeme techniku „obráceného Y“, kterou získáme, pokud do obou polí vytvoříme vykrývací bloky chránící ledviny, střevo a kaudální střední část pánve s močovým měchýřem.
Nádory centrální nervové soustavy (CNS) (astrocytom, glioblastom, meduloblastomy, meningeomy, ozařování kraniospinální osy, aj.)
Ozařovací technika je volena podle lokalizace a velikosti cílového objemu. Nejčastěji aplikujeme 2 protilehlá LL pole či 2 konvergentní (divergentní) pole. Pole opět může být nepravidelného tvaru, proto se využívá MLC či vykrývacích bloků. Při ozařování kraniospinální osy se oblast mozkovny s kraniální částí míchy ozařuje 2 protilehlými LL poli.
Hodgkinova nemoc
U postižení lymfatického systému se aplikují 2 protilehlá AP pole nejčastěji s vykrytím kritických orgánů a s nerovnoměrným zatížením jednotlivých polí. Využívají se speciální ozařovací techniky (viz. speciální ozařovací techniky).
Paliativní radioterapie (metastázy skeletu, mozku, jater)
U paliativního ozařování volíme co nejjednodušší, ale zároveň co nejefektivnější techniky. U metastáz skeletu a jater aplikujeme techniku dvou protilehlých předozadních polí a u mozkových metastáz volíme techniku dvou laterolaterálních polí. Technika a délka ozařování závisí na celkovém stavu pacienta a polohu pacienta se snažíme maximálně fixovat a zároveň se snažíme, o co největší pohodlí pacienta.
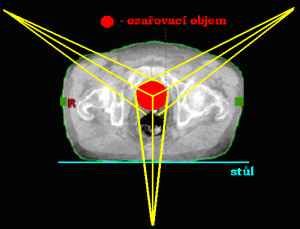
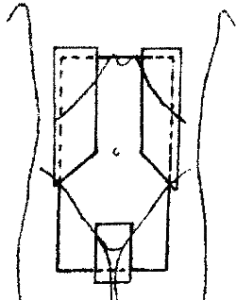
Ozařování pomocí tří polí
Rozdělujeme je podle toho, jaký úhel CP jednotlivých polí mezi sebou svírají (podle kritických orgánů) na:
T techniku – CP tří polí mezi sebou svírají úhel 180° (resp. 90°). Jde o kombinaci 2 protilehlých LL polí s 1 přímým polem či protilehlých AP a PA polí s 1 laterálním polem. Velmi často jsou do dvou protilehlých polí vkládány klínové filtry, díky nímž dojde k homogenějšímu rozložení dávky v hloubce ozařovaného objemu.
Y techniku – CP tří polí mezi sebou svírají úhel 120°. Jde o kombinaci 2 divergentních polí s 1 přímým polem či 2 divergentních polí s jedním laterálním polem.
Tři šikmá pole – CP 3 polí mezi sebou svírají libovolný úhel. Ten je volen při plánování radioterapie plánujícím fyzikem s ohledem na ozařovaný objem.
Využití kombinace 3 polí
Kombinace 3 polí se používá pokud, cílový objem je uložen hluboko pod povrchem kůže pacienta a díky této technice docílíme rovnoměrného ozáření cílového objemu a šetření okolních zdravých tkání. Často jsou aplikovány již u zmenšeného cílového objemu (boostu) po předchozí aplikované dávce. Při použití 3 a více ozařovaných polí se většinou zvětšuje celková integrální dávka záření.
Zhoubné nádory GITu (nádorů konečníku, anu, žlučníku a žlučových cest, slinivky břišní)
Používáme T techniku, kdy se jedná o kombinaci 2 laterolaterálních polí s klíny a 1 přímého pole. Při ozařování karcinomů konečníku (někdy i u karcinomů anu, pokud nechceme ozařovat tříselné lymfatické uzliny) leží pacient na břiše ve speciální podložce – bellyboardu. Naopak při ozařování nádorů žlučníku, žlučových cest, slinivky břišní a anu (s ozařováním tříselných lymfatických uzlin) volíme polohu supinační, tedy na zádech.
Bronchogenní nádory (karcinomy plic, nádor nosohltanu a paranasálních dutin)
Bronchogenní nádory můžeme ozařovat T technikou, Y technikou i 3 šikmými poli s individuálním vykrytím. Techniky se nejčastěji aplikují u „velkých objemů“. Výběr techniky závisí na lokalizaci cílového objemu. Snažíme se o maximální šetření míchy a zdravé plíce.
Maligní nádory močového měchýře a ledvin a mužských pohlavních orgánů (prostaty)
Pro ozařování nádorů močového měchýře aplikujeme T techniku (s individuální úpravou tvaru pole vykrývacími bloky či MLC), která je složena ze 2 protilehlých laterolaterálních polí a jednoho přímého AP pole. Snažíme se o co největší šetření rekta.
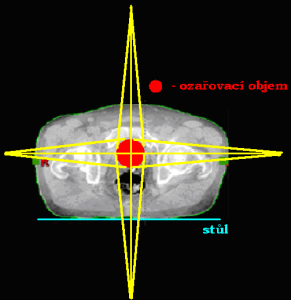
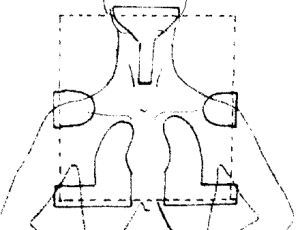
Ozařování pomocí čtyř polí
Častá technika při ozařovaní z více polí. Ideální technika pro uložení objemu v různé hloubce. Rozdělujeme je podle úhlu, který svírají CP polí se sagitální
a frontální rovinou, na:
BOX technika
Centrální paprsky protilehlých polí (2 protilehlých AP/PA polí a 2 protilehlých laterolaterálních polí) leží v rovině sagitální a frontální. Použití: oblast pánve (gynekologické nádory, nádory konečníku) a oblast hrudníku.
Protilehlé centrální paprsky jsou na sebe kolmé, s rovinou sagitální a frontální však svírají určitý úhel.
Technika křížového ohně
Centrální paprsky protilehlých polí (2 a 2 protilehlá kontralaterální pole) svírají se sagitální a frontální rovinou určitý úhel.
Využití techniky 4 polí
Maligní nádory GITu (nádorů konečníku, žlučníku a žlučových cest, slinivky břišní) – BOX s individuálním vykrytím.
Bronchogenní nádorů (karcinomy plic) – obě techniky
Gynekologické nádorů (nádory pochvy, těla dělohy, karcinomy děložního čípku)
– BOX technika s individuálně vytvarovaným polem.
Maligní nádory ledvin a močového měchýře a maligní mužských pohlavních orgánů (karcinomy penisu, prostaty) – obě techniky.
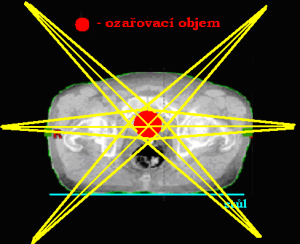
Ozařování pomocí pěti a více polí
Technika ozařování více polí se používá pro malá ložiska, protože mimo cílový objem je v okolních tkáních dávka charakterizována příkrým spádem. Nejčastěji se využívá ozařovací techniky 6 polí (u karcinomu prostaty, nádorů ledvin, aj.). Méně se pak používá technika 5 polí (také u karcinomů prostaty).
V praxi se více používá rotační technika ozařování. Při stereotaktické ozařování se naopak s výhodou používá ozařování z více polí.
Nestejné zatížení ozařovacích polí
Jde o různé zatížení jednotlivých polí při excentricky umístěném ozařovacím objemu s cílem homogenního ozáření cílového objemu, který není umístěn ve středu ozařovacího objemu.
Jestliže tumor je lateralizován (je více na jedné straně) – s výhodou se používá technika 2 protilehlých polí s nestejným zatížením. Průběh a tvar izodóz zůstává nezměněn a tam, kde je jenom nižší zatížení pole je ½. Postiženou stranu zatížíme 100% izodózou a z druhé strany můžeme dát 50%, 40%, tedy vždy nižší. Tato technika se dá provádět i u 3 polí, 4 polí, atd. Posuneme dávku záření na postiženou stranu a tím šetříme zdravé tkáně na straně protilehlé.
TVAROVÁNÍ POLÍ A MULTI-LEAF COLLIMATOR
Podle požadavku na ozáření cílového objemu, je možné tvarovat svazek záření tak, aby došlo k maximálnímu ozáření cílového objemu s danou geometrií. Svazek záření lze tvarovat dvojím způsobem, buď klasickými litými bloky, nebo vícelistovým kolimátorem (MLC), který je pro 3D-CRT téměř ideálním prostředkem. Nevýhodou bloků je totiž i skutečnost, že po každém ozáření jednotlivých polí je nutná výměna bloku (buď jeho odstranění, nebo náhrada za jiný blok, jenž je určen pro další pole). Další nevýhodou je pracné zhotovení každého bloku, a to především při použití velkého počtu polí.
MLC bývá osazen na hlavici lineárního ozařovače a slouží ke kolimaci fotonového svazku záření. Je tvořen lamelami (např. z wolframu), které mají po stranách výstupky, kterými do sebe zapadají a na konci jsou zaoblené. Pohyb lamel je navzájem nezávislý (každá je poháněna vlastním motorkem) a definováním pozice jednotlivých lamel se určuje velikost a tvar ozařovaného objemu.
Výhody MLC oproti blokům:
- MLC umožňuje techniku dynamického bloku a dynamický režim tzv. modulace intenzity v ozařovaném poli
- Rychlejší příprava a provedení léčby, neboť odpadá vylévání bloků v dílně
a montáž na kolimátor hlavice přístroje v ozařovně - Úspora financí
- Kratší pobyt pacienta na ozařovně (zvýšení komfortu) a hlavně kratší nastavovací čas (set-up time)
Nevýhody MLC:
- Propustnost záření v místě styku protilehlých listů
- Rozložení dávky na okrajích pole je nehomogenní
- Koncové části listů způsobují polostín
- Velikost pole je limitována, a tedy MLC neumožní ozáření u některých velkoobjemových technik
- MLC není vhodný k vykrývání míchy a očí (moderní MLC tuto nevýhodu eliminují)
MLC je v moderním pojetí samotné radioterapie nezbytnou podmínkou pro aplikaci IMRT technik a stal se standardem vybavení radioterapeutických pracovišť. Kontinuální pohyb jednotlivých lamel je zajišťován elektromotorem (každá lamela umožňuje nezávislý pohyb vůči ostatním). V průběhu vlastní radioterapie je kontrolována pozice jednotlivých lamel pomoci vysílaného signálu, pokud dojde k poruše signálu (nízká hladina signálu pro detekci, chyba v pozici jednotlivé lamely), systém přeruší ozařování.
SPECIÁLNÍ OZAŘOVACÍ TECHNIKY
Speciální ozařovací techniky jsou:
- velkoobjemové ozařování
- celotělové ozařování
- pohybová technika ozařování
- stereotaktické ozařování
- tomoterapie
- intensity modulated radiotherapy (IMRT)
- obrazem řízená řízena radioterapie (IGRT)
U některých technik (velkoobjemové ozařování, celotělové ozařování a pohybová radioterapie) jsou jednotlivé dávky nižší než u klasických ozařovacích technik (1 – 1,8 Gy). Velmi brzy dochází ke změnám hodnot v krevním obraze, a proto je nutné jej sledovat 2x týdně. Naopak u stereotaktické radioterapie může být jednotlivá dávka mnohem vyšší. IMRT využívá klasické ozařovací frakcionace, stejně jako tomoterapie.
Velkoobjemové ozařování (magma – field therapy)
Při velkoobjemovém ozařování používáme techniku dvou protilehlých AP/PA polí, díky kterým ozařujeme velký objem pacienta velkými poli.
Charakteristiky velkoobjemového ozařování
- využití velkých polí
- využití velké vzdálenosti, minimálně 100 cm
- jednotlivé dávky jsou malé (v průběhu ozařovací série se zvyšují), celková dávka je nižší, než u lokoregionální radioterapie, limitujícím faktorem je celková tolerance pacienta
- sleduje se odpověď organismu na ozáření a zároveň dochází k určité adaptaci pacienta
- reakce na ozařování mají charakter celkových obtíží, velmi brzy dochází ke změnám v krevním obraze
Technika pláště (mantel technika)
Využívá se při léčbě Hodginovy choroby. Ozařujeme tak všechny uzlinové oblasti nad bránicí. Protože ozařujeme velkou oblast zájmu, vyráběly se vykrývací bloky na vykrytí laryngu, hlavic humerů, plic (popř. krční a hrudní páteře, mozkového kmene a dutiny ústní), které byly vytvářeny na základě verifikačních snímků a původních nálezů, dnes jsou plně nahrazeny MLC. Pacient leží na zádech, pod hlavou má polštář (popř. hlava v masce), ruce mírně abdukovány (roztaženy) a přiloženy k ingvinám. Šíje je natažená tak, aby ústní dutina byla mimo ozařované pole, hlava je tak dorzálně zakloněna.
Technika obráceného „Y“ a technika hokejky
Využívá se při léčbě Hodginovy choroby a ozařování seminomu varlete. Ozařujeme všechny uzlinové oblasti pod bránicí (paraaortální břišní, oboustranné pánevní a ingvinální). Vykrývají se ledviny, kaudální část pánve s močovým měchýřem a střeva.
Spray technika
Touto technikou se ozařuje pokročilé stádium rakoviny vaječníků. Jde o ozáření celé dutiny břišní. Kritickými orgány jsou zde ledviny a játra (po dosažení 20 Gy), které vykrýváme bloky.
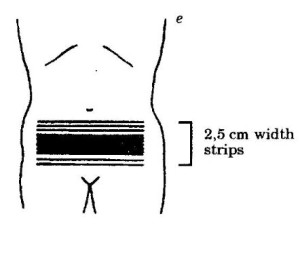
Alternativou spray techniky je americká metoda moving strip (technika postupujících pruhů) u nádorů vaječníků. Celá dutina břišní je rozdělena na pásy o šíři
2,5 cm, jednotlivé pásy se postupně ozařují (nejprve se ozařuje pás široký 2,5 cm, 5 cm, 7,5 cm a pak 10 cm). 10 cm širokým pásem se po 2 dnech postupuje o 2,5 cm kraniálně nebo kaudálně. Každý bod ve střední rovině je ozářen 8x, biologický ekvivalent je vyšší, než
u spray techniky a má lepší snášenlivost.
Segmentové ozařování 1 či obou plicních křídel (paliativní terapie) se volí při mnohočetné diseminaci choroby do plic nebo při nádorovém výpotku.
Pohybové ozařování
Při pohybové terapii se zdroj pohybuje kolem pacient, výjimečně se pacient otáčí kolem zdroje. Jedná se o ozařovací techniku skládající se z mnoha malých polí, která se plynule střídají. Pohybovou terapii dělíme podle vztahu k dlouhé ose pacienta na:
- rotační terapii – zdroj se kolem pacienta otočí o 330° – 360°. Hloubková dávka se symetricky rozloží kolem osy rotace. Této techniky se příliš nevyužívá.
- kyvadlovou terapii – zdroj obíhá okolo pacienta pod menším úhlem než u rotační terapie. Jde o kyvy, které mohou být jednoosé (ozařování močového měchýře, uzlin v mediastinu, orbity) a dvojosé. U dvojosé kyvadlové terapie dochází ke dvěma a více kyvům podél dvou os pacienta (ozařování lůžka ledviny po jejím odstranění a přilehlých paraaortálních uzlin, ozařování prostaty). Tyto techniky se aplikují při ozařování urologických zhoubných nádorů či u celotělového ozařování. Podle vztahu ke krátké ose pacienta hovoříme o konvergentním ozařování.
Celotělové ozařování – TBI (total body irradiation)
Je součástí především přípravy před transplantací kostní dřeně u pacientů s leukémií, dále u pacientů s lymfomem, seminomem a jinými solidními diseminovanými nádory. Díky tomuto ozařování dochází ke snižování počtu přežívajících nádorových buněk a umožnění přijetí dárcovské kostní dřeně. Plánovacím cílovým objemem značíme celé tělo včetně kůže a bod referenční dávky je stanoven ve středu břicha v oblasti pupku. Poloha pacienta při ozařování je různá. Nejčastěji pacient leží na speciálním ozařovacím lůžku tvaru kolíbky v supinační poloze po dobu čtyř kyvů gantry přístroje a po dobu další čtyř kyvů gantry nemocného pokládáme do pronační polohy. Tato technika využívá pohybovou terapii a může být nazvána „sweeping beam“ technikou, kdy úhel každého kyvu je 120°. Nad pacienta jsou umístěny plexisklové desky o tloušťce 1 cm, které nám umožňují dosáhnout správnou homogenitu záření.
Aplikuje se dávka 2 Gy v 6 frakcích hyperfrakcionačním režimem. Nastavujeme pacienta na SAD vzdálenost 100 cm za předpokladu ozáření pomocí lineárního urychlovače s E = 6 MeV. Při každém ozáření se provádí in vivo dozimetrie v určených bodech a po první frakci, v případě nesouhlasu naměřené dávky s naplánovanou, dochází ke korekci počtu monitorovacích jednotek. Na oblast plic se používají se individuální vykrývací bloky. V průběhu ozařovacího cyklu mohou nastat komplikace jako například plicní pneumonitida a fibróza či poškození očních čoček.
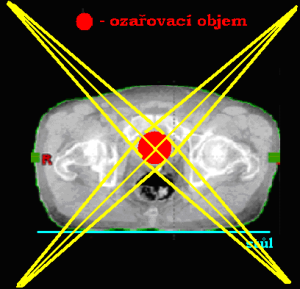
Stereotaktické ozařování
Využívá se v radioneurochirurgii. Pojem „stereotaktický“ značí přesné prostorové vymezení objemu bez přímé kontroly zraku pomocí souřadnicového systému. Jedná se o ozáření vysokými dávkami v jedné či několika málo frakcích do malého cílového objemu se strmým úbytkem dávky do okolí objemu. Záření je kolimováno do úzkých svazků, které se kříží v 1 ohnisku (izocentru). Izocentrum se umísťuje do středu cílového objemu, na dávce záření se podílejí křížící se paprsky. Mimo ohnisko dávka záření do okolí prudce klesá a již v malé vzdálenosti od ohniska (cca několik mm) odpovídá dávka prakticky dávce z jednoho svazku.
Stereotaktická radiochirurgie
Na rozdíl od klasické radioterapie představuje jednorázově fokusované ozáření aplikované cíleně do chorobného ložiska s prudkým poklesem dávky do okolní tkáně, zatímco radioterapie aplikuje dávku v několika frakcích a ozařuje větší objem zdravé tkáně. Radiační dávka aplikovaná v 1 frakci navozuje větší radiobiologický efekt, než stejná dávka distribuovaná v mnoha frakcích. Limitem pro radiochirurgii je objem samotného maligního ložiska, pro jednorázové fokusované ozáření jsou vhodná chorobná ložiska do průměru 3 – 4 cm.
Stereotaktická radioterapie
Stereotaktická radioterapie umožňuje překlenout hranice limitujícího objemu a zohlednit radiobiologii některých nádorů. Místo jednorázové fokusace je zvolen optimální frakcionační režim – akcelerovaný 5 x 5 Gy nebo standardní 5 x 2 Gy.
Metody stereotaxe:
- izocentricky fokusované γ záření z velkého počtu zdrojů – Leksellův gama nůž
- izocentricky fokusované záření X (RTG) z lineárního urychlovače – BrainLab
- těžké nabité částice produkované urychlovačem částic
Princip stereotaxe je založen na přesné prostorové lokalizaci cílového objemu pomocí 3D zaměřovacího systému a pokročilých zobrazovacích metod (MR, CT, PET apod.).
Leksellův gama nůž
Využívá se především pro léčbu nádorových onemocnění v oblasti CNS. Hlava pacienta je pevně fixována do speciálního rámu s návraty do kostí mozkovny. Používá se protonový svazek synchro a cyklotronů (ekonomicky náročná záležitost), brzdné fotonové záření lineárního urychlovače (aplikace pohybové terapie) nebo právě Leskellův gama nůž. Přesnost zaměření pomocí fixovaného koordinačního aparátu je 1 – 2 mm.
Je tvořen 201 malými kobaltovými zářiči rovnoměrně umístěnými v hlavici přístroje (hemisféra o průměru 400 mm) v 5 cirkulárních řadách. Každý zdroj je se skládá z 12 – 20 válcových pelet radioaktivního kobaltu o průměru a délce 1 mm, které jsou umístěny a hermeticky uzavřeny ve 2 válcových pouzdrech. Záření každého zdroje je kolimováno třemi kolimátory (2 jsou stacionárně umístěné v radiační jednotce a 1 je umístěn v kolimační helmici). Svazky jsou směrovány do centra s přesností 0,3 mm a každý svazek je možné separátně odstínit.
Indikace a výhody LGN
- Hloubka a nepřístupnost nádoru, kdy je nemožné provést chirurgickou resekci
- Malignita v lokalizaci CNS – minimální poškození okolní mozkové tkáně
- Těsná lokalizace u artérií a nervů
- Vyloučení rizika krvácení, infekcí a dalších komplikací spojených s operačním výkonem
- Krátká doba hospitalizace
- 70% ceny ve srovnání s klasickým neurochirurgickým výkonem
Komponenty LGN:
- radiační jednotka
- Leksellův stereotaktický rám
- Plánovací systém
Stereotaktický systém pro lineární urychlovač
Oproti Gama noži využívá stereotaktický systém lineárního urychlovače jen 1 zdroj záření (elektronové dělo urychlovače), který s kyvem ramene urychlovače a rotací ozařovacího stolu mění místo vstupu svazku záření. Běžný kolimační systém lineárního urychlovače je pro stereotaktické ozařování nevhodný (svazek záření má relativně velký polostín a clony neumožňují nastavování s dostatečnou přesností). Proto se na kolimační systém urychlovače připevňuje nástavec pro speciální kolimátory s kruhovým průměrem (5 – 40 mm). Další možností jsou již moderní MLC s malou velikostí jednotlivých lamel (2 – 5 mm).
K stereotaktickému ozáření se používají standardní izocentrické urychlovače s určitými modifikacemi, mezi které patří:
- doplňková kolimace v podobě buď sady kolimátorů, které vymezují malá kruhová pole (kónické tubusy), nebo vícelistého mikrokolimátoru (μMLC), který vymezuje různá nepravidelná pole
- na dálku řízená rotace ozařovacího stolu
- držáky na imobilizaci stereotaktického rámu během ozáření
Stereotaktická maska
Stereotaktická fixační maska patří mezi neinvazivní imobilizační pomůcky. Je vyrobena z termoplastického materiálu a připravuje se pro každého pacienta individuálně. Skládá se z vrchní a spodní části, které se dají uzamknout a vytvoří tak úplné „pouzdro“ hlavy, které zajišťuje imobilizaci pacienta v průběhu radioterapie. Maska je připevněna na stereotaktický neinvazivní rám tvaru podkovy, který je fixován na konec ozařovacího stolu. Tato maska je použita společně s dentální fixací a otiskem kořene nosu. Koordinační systém je pak definován pomocí neinvazivního stereotaktického rámu, který se připevňuje na tuto masku.
Stereotaktická maska rovněž umožňuje frakcionovat celkovou dávku – dovoluje aplikovat nižší dávku na frakci a navýšit počet frakcí (což u Gama nože není možné z důvodů invazivní fixace stereotaktického rámu).
Cyber Knife
Další moderní přístroj pro stereotaktické ozařování. Je složen z robotického ramene s velkou škálou možností pohybu. Cyber Knife rozšiřuje možné indikace použití nejen na oblast CNS, ale i na dříve obtížné lokalizace (hrudník, pánev). Je založen na technologii lineárního urychlovače velmi malé hmotnosti o energii 6 MV s celkem 12 kolimátory kruhového průřezu (5 – 60 mm). Systém umožňuje použít jak izocentrické ozáření, tak i nonizocentrické.
Rozšíření lokalizací na oblasti zatížení různými neovlivnitelnými pohyby (dýchací pohyby, srdeční činnost) je umožněno kontinuálním snímáním pozice pacienta a nádoru během vlastního ozařování. Verifikaci zajišťují 2 RTG snímače, které jsou umístěny na strop ozařovny a detektory, které musí být situovány na podlohu pod polohovací stůl tak, aby svazky záření z RTG snímačů procházely vždy skrze cílový objem a registrovaly se na protilehlý detektor a tím umožňovaly určit okamžitou pozici ložiska v daný moment. Se změnou pozice nádoru dojde k přerušení ozařování s následnou změnou pozice robotického ramene tak, aby svazek záření opět směřoval do cílového objemu. Po úpravě polohy ramene dochází k automatickému sepnutí záření systémem.
IMRT
Intensity Modulated Radiotherapy
Speciální metoda konformní radioterapie, jejichž podstatou je rozdělení svazku záření na jednotlivé paprsky s různou intenzitou (možná změna intenzity záření). Rozložení dávky přesně odpovídá tvaru nádoru v prostoru při maximálním šetření zdravých tkání. Jedná se o techniku využívající kombinaci více ozařovacích polí.
Svazek je rozdělen na jednotlivé pixely, které mají rozdílnou intenzitu záření díky naprogramovanému pohybu lamel MLC během ozařování. Požadovaná dávka je aplikována do plánovacího cílového objemu (PTV) a mimo něj dochází k prudkému spádu dávky. Z toho také vyplývá výhoda oproti 3D-CRT (trojrozměrné konformní radioterapii), že dochází k šetření zdravých tkání a orgánů i v oblastech konkavit PTV. Ke zjištění optimálního rozložení aktivit ve svazcích se používá inverzní plánování. Po stanovení těchto principů rozdělí počítač (se speciálním softwarem) jednotlivé svazky na pixely a mění v nich intenzitu do doby, než je proces optimalizován, čili než prostorová distribuce dávky vyhovuje požadavkům lékaře. Jakmile se nalezne optimální řešení, dochází k převedení relativních intenzit jednotlivých paprsků do pohybů lamel MLC. Většinou jsou IMRT techniky porovnávány s konvenčními a především konformními technikami využívající pevných vykrývacích bloků. Diagnózy s prokázaným klinickým přínosem jsou nádory mozku, hlavy a krku, karcinom prostaty, gynekologické malignity a některé nádory baze lební. Diagnózy s předpokládaným přínosem jsou nádory retroperitonea, karcinomy štítné žlázy a nádory v oblasti páteře.
U nádorů v oblasti hlavy a krku při konvenční radioterapii si přítomnost rizikových orgánů (mícha, oči, mozkový kmen, optické nervy) vynucuje redukci dávky v cílovém objemu. Rovněž není možné efektivně snížit aplikovanou dávku na slinné žlázy, což s následným rozvojem xerostomie vede ke zhoršené kvalitě života pacienta. Výhoda IMRT spočívá v možnosti efektivně redukovat dávku v kritických orgánech při dodržení maximální dávky na nádorovou tkáň s cílenou nehomogenitou záření v závislosti na nádorovém postižení okolní tkáně.
Podmínkou radioterapie pomocí IMRT je MLC, který kontinuálně vytvoří nepravidelný tvar pole podle ozařovacího plánu. Okraje lamel kopírují vhodně ozařovaný objem a eliminují vznik polostínu. Každé pole je rozloženo na segmenty, ve kterých jsou individuálně vytvarovaná pole MLC. Během ozáření dochází ke změně polohy jednotlivých lamel a dochází k modulaci intenzity svazku záření a tím i dávky v jednotlivých částech ozařovaného objemu. Kombinací takto modulovaných polí z různých směrů se dosahuje optimálnějšího rozložení dávky, selektivního ozáření cílové tkáně při lepším šetření okolní tkáně a kritických orgánů.
Nevýhody IMRT
- Především technické požadavky na ozařovač (lineární urychlovač s MLC umožňujícím IMRT), dále plánovací software umožňující inverzní plánování.
- Nutnost naprosto přesné definice jednotlivých objemů v CT, MR, SPECT, PET obrazech
a programy potřebné k fúzi těchto obrazů v plánovacích systémech (provedení i zajištění kvality IMRT). - Nákladné fixační pomůcky zajišťující přesnou reprodukovatelnost ozařovací polohy.
- Časově náročné definování objemů, proces inverzního plánování, dosimetrie, verifikace
a to u každého pacienta. - Vysoké nároky na zkušenosti a kvalifikaci personálu (radioterapeuty a fyziky)
- Zásadní nevýhodou je však cenová náročnost u přístrojového, softwarového, fixačního
a dozimetrického vybavení, což se odráží na ceně léčby každého pacienta.
Výhody IMRT
- Významem pro kvalitu života je především šetření zdravých tkání a orgánů.
- V rizikových orgánech je nižší dávka a v cílovém objemu navýšená
Z hlediska časového řízení můžeme rozdělit techniku IMRT na:
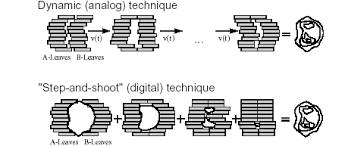
- Step and shoot („krok a výstřel“, přerušovaný režim) – ozařovací pole je rozděleno
na několik segmentů s vlastním nastavením lamel a vlastní dávkou. Lamely MLC jsou v pohybu jen v přestávkách mezi jednotlivými segmenty, intenzita uvnitř každého segmentu je konstantní. Po ozáření jednoho segmentu se ozařování přeruší, změní se úhel gantry
a MLC následně vytvaruje ozařované pole, poté co je pole vytvarováno se opět spustí ozařovací režim – delší ozařovací čas. Technice se také říká technika mnoha statických polí (MSF – multi static field) – používá se jako jedna z metod 4DRT.
- Sliding Windows (kontinuální režim) – protilehlé páry lamel kolimátoru se kontinuálně přemisťují napříč svazkem do požadovaného tvaru, aniž by došlo k přerušení záření – dynamický režim. Celá synchronizace je řízena příslušným softwarem, (pohyb hlavice, kolimátoru a jednotlivých lamel), zároveň dochází ke kontinuální změně dávkového příkonu v průběhu ozařování. Svazek je zapnut po celou dobu pohybu lamel. Celé ozáření proběhne během jedné otáčky o 360°. Tento typ IMRT se označuje jako Intensity Modulated Arc Therapy (IMAT).
Rozložení dávky při technice IMRT je ve srovnání s konvenčními postupy relativně výhodnější, zároveň je mnohem složitější. Pro dosažení lepší distribuce dávky v cílovém objemu je někdy nutno zvětšit počet polí (resp. objem exponovaných zdravých tkání oproti konvenčním technikám). Rozložení dávky je v okolí zdravých tkání často záměrně nehomogenní. Vysoká přesnost ozáření přináší podstatě menší ozáření okolí postižených oblastí vysokými dávkami záření. Tento příznivý výsledek IMRT technik z hlediska rizika komplikací může ale vést ke zhoršení terapeutických výsledků. Pokud je při konvenční technice ozářena oblast zdánlivě s absencí maligního postižení, přesto zde již může existovat subklinické postižení, které je konvenční radioterapií zlikvidováno. Naopak při využití IMRT techniky, kdy je kladen důraz na přesnost a minimalizaci cílového objemu, může dojít v takovém případě k relapsu onemocnění. Neméně důležitým faktorem limitující indikaci IMRT je celková doba pobytu pacienta v ozařovně. Při konvenční terapii pacient stráví maximálně 4 minuty na vyšetřovacím stole, kdežto u IMRT se doba prodlužuje na 10 – 18 minut (záleží na počtu polí a segmentů v každém poli). Tudíž v tomto případě při volbě ozařovací techniky musí bezpodmínečně lékař brát na zřetel nejenom vlastní lokalizaci a vhodnost techniky, ale hlavně celkový stav pacienta.
Jednoznačnou indikací radioterapie je, když konvenční a konformní radioterapie už neumožňuje bezpečnou aplikaci nádorové dávky do PTV pro překročení tolerančních dávekna rizikové struktury. Dále nádory hlavy a krku, prostaty, cervixu, plic apod.
Z hlediska úzkého vztahu cílového objemu a plánované dávkové distribuce jsou IMRT techniky spjaty s rozvojem verifikačních technologií. Pokud nám IMRT umožňuje redukovat cílový objem, je nutné dostatečně ověřit, zda je předepsaná dávka distribuována do předem definovaného objemu. S rozvojem IMRT souvisí rozvoj kilovoltážní verifikace pomocí přídatného zařízení k systému lineárního urychlovače (CBCT, OBI) a zdokonalovaní již standardně používaného portálového verifikačního systému (MVCT), který se inspiruje CBCT.
IMRT umožňuje redukovat radiační zatížení zdravých tkání, což je velmi podstatné u nádorů v oblasti hlavy a krku. U této diagnózy je léčba zpravidla spojena s váhovým úbytkem, což s sebou nese možnost změny lokalizace a velikosti původního cílového objemu a změnu lokalizace kritických orgánů. V rámci optimalizace radioterapie se provádí kontrolní CBCT nebo CT s posouzením regrese nálezu a dávkové distribuce. Algoritmus verifikace posuzování platnosti původního plánů je individuální záležitostí každého pracoviště (19 – 21 fx). Konfrontace původního CT s kontrolním v průběhu léčebného procesu umožňuje odhalit změny v dávkové distribuci s následnou reoptimalizaci léčebného plánu.
IMRT ve zkratce:
- u IMRT je problém s pohyblivostí lidského těla (dýchání, současně peristaltika a náplň močového měchýře)
- nové možnosti pro léčbu ložisek, která těsně naléhají na kritické orgány
- IMRT použije stejné svazky jako 3D konformní RT a softwarově je rozdělí do několika paprsků (BEAMLETS), aby pomocí nich mohla řídit intenzitu svazku → umožňuje vykrytí jakékoliv části kritického orgánu, což by u 1 pole způsobilo poddávkování tumoru
IGRT
– radioterapie řízená obrazem (image-guided radiation therapy)
IGRT kombinuje techniku IMRT se zobrazovací technikou (v hlavici je zdroj
i rentgenka). Jedná se tedy o 3D zobrazení anatomických struktur v reálném čase (4D radioterapie). Tato technika je svým významem a přínosem do radiační onkologie řazena vedle techniky IMRT. Umožňuje eliminaci chyb v polohování pacienta mezi jednotlivými ozařovacími frakcemi, příp. i změn polohy cílové tkáně a okolních anatomických poměrů v průběhu radioterapie.
Přístroj pro IGRT poskytuje přizpůsobení ozařovacích protokolů a umožňuje dosažení vyšší přesnosti v nastavování pacienta a následného ozáření. Díky okamžitému přístupu k informacím o anatomických poměrech v závislosti na ozařovací poloze, lze upravovat ozařovací protokoly. Nejvýznamnější výhodou je možnost provést jakoukoliv změnu v nastavení pacienta či opravení ozařovacího plánu.
Ozařovač je vybaven přídavným RTG zobrazovacím systémem, tzv. OBI (On-Board Imager System) nebo XVI (X-ray Volume Imaging), který se používá pro kontrolu pozice pacienta nebo cílové tkáně před vlastním ozářením nebo v průběhu ozařování. Před ozářením se provede verifikace pozice pacienta širokým konickým svazkem RTG – tzv. cone beam CT (rentgenka během 1 rotace vytvoří kompletní 3D objemový datový CT soubor), poté následuje fúze (srovnání) obrazu s CT skeny získanými při plánovacím CT vyšetření (ze simulátoru) s případnou korekcí pozice pacienta (při větších rozdílech se změní v ozařovacím plánu). Rentgenový objemový zobrazovač snímá a rekonstruuje data v celém objemu, tudíž vzniklé řezy není nutné rekonstruovat jako na CT. Zrekonstruované řezy se superponují s těmi z plánovacího CT, dokud se požadované struktury co nejdokonaleji nepřekrývají. Následně IGRT software vypočítá odchylky od původního zobrazení nutné ke korekci nastavení. Při minimálních odchylkách stačí opravit pozici stolu, pokud jsou velké – konzultace s lékařem.
Alternativou cone beam CT je verifikace pomocí statického RTG snímku (obdoba portálového zobrazování s lepší verifikační schopností). Možnost pořízení statického RTG snímku je u lineárních urychlovačů se systémem OBI a jako paralelní software
u urychlovačů s modem cone beam CT.
RTG zobrazovací systém poskytuje aktuální obrazy orgánů v oblasti lokalizovaného PTV dané správnou pozicí uložení pacienta před ozářením a na tomto základě se optimalizuje přesnost radioterapie (důležité pro IMRT techniku).
výhody: lepší ochrana kritických orgánů; homogennější ozáření objemu
nevýhody: vyšší integrální dávka, vyšší počet polí; časově náročnější
IGRT může být dosažena způsobem off-line nebo on-line.
Off-line spočívá ve způsobu převedení zjištěných změn v pacientově anatomii do provedení korekcí ozáření a vytvoření nového ozařovacího plánu. Nový plán zahrnuje úpravy v nastavení ozařovací polohy, změny tvarovacích clon, jednotlivých polí nebo jejich zatížení.
On-line způsob iViewGT může být proveden při ozařování, pokud je očekávaný pohyb sledovaných struktur menší a předpokládaný. Oprava pak zahrnuje pouze translační pohyby stolu nebo modifikaci tvaru svazku užitím MLC. Po provedení všech korekcí může ozáření se zajištěním přesného cílení a nastavení proběhnout.
Při každém nastavení pacienta na urychlovači je důležité, aby byl ve stejné poloze vůči jednotnému souřadnému systému, jako byl v okamžiku pořízení CT série, na kterém byla naplánovaná léčba. Dávková distribuce spočítaná na CT modelu pacienta pak bude odpovídat skutečné dávkové distribuci v těle pacienta. IGRT technika je zcela nový efektivní způsob léčby v důsledku absolutně přesné lokalizace nádoru, čímž je eliminován škodlivý radiobiologický účinek na okolní zdravé tkáně.
Klinické využití IGRT:
Klinické využití metody IGRT vede ke snížení komplexní distribuce dávky v prostorově složitých tvarovaných nádorech. Díky tomu můžeme zmenšit bezpečnostní lemy při definici cílového objemu a tím i zmenšíme objem ozařované tkáně spolu s nádorem, což za předpokladu toleranční radiační zátěže tkáně umožňuje zvýšení terapeutické dávky a také zvýšení pravděpodobnosti kontroly nádoru. Metoda IMRT tedy umožňuje realizovat prostorově složitě tvarované distribuce dávky v těle pacienta a využít tak potenciálu IGRT.
IGRT může být vybavena i systémem pro korekci dýchacích pohybů tzv. Respiratory Motion Technology či Real-Time Position Management (RPM), umožňujícím sledování změny polohy cílového objemu v závislosti na dýchacím cyklu pacienta. Všechny tyto postupy se nyní integrují do systému DART (Dynamic Adaptive Radiotherapy), který umožňuje vyhodnocovat výsledky získané při IGRT
a na jejich základě operativně adaptovat parametry ozařovací procedury tak,
aby distribuce dávky byla optimální.
Možnosti IGRT:
Systémy pro IGRT jsou různé, zpravidla se jedná o jiné konstrukční řešení
a princip vzniku verifikačního obrazu.
- CBCT (CT IGRT)
- Helical Tomotherapy IGRT
- v CT přístroji je zabudován zdroj fotonů
- pacient projíždí gantry a je ozařován modulovanou dávkou kontinuálně
- výhoda: spojení celého procesu do 1 přístroje (plánování, simulace, verifikace, ozařování)
- nevýhoda: nutnost mít celý nový stroj; není možné použít pro některé lokality
- Cyber Knife IGRT
- IGIM Proton Therapy
TOMOTERAPIE
Diagnostická zobrazovací a terapeutická ozařovací technologie je zde integrována do jednoho systému (dochází k fúzi terapeutického lineárního ozařovače a CT skeneru). Tomoterapie nebo spirálová tomoterapie je definována jako radioterapie s modulovanou intenzitou svazku (IMRT) kontrolována CT.
CT zobrazení je realizováno jako transmisní spirálové CT, kde místo rentgenky je lineární urychlovač s maximální energií 6MV (SAD 85 cm), produkujícím v režimu „low dose“ (se sníženou energií a hlavně s mnohonásobně nižší intenzitou svazku) fotonové záření („megavoltové X-záření“) – Cone Beam (MVCT). Výhodou v podobě zobrazování pomocí MVCT můžeme považovat nepřítomnost přídatného zařízení (kV zdroje) k následné verifikaci. Tato výhoda (popř. nevýhoda) může být značně diskutabilní, protože stále je používán jako zdroj záření pro verifikaci lineární urychlovač. Tato skutečnost s sebou nese limitace v podobě nízké zobrazovací schopnosti, kontrastu a poměru signál – šum. Možnou další výhodou je redukce kovových artefaktů u vysoce denzních objektů (implantované kovové předměty – TEP apod.). Podobně jako u CT diagnostiky, spolu s rotací urychlovače a detektorů se posouvá i lehátko s pacientem (helikální či spirální skenování), s následnou rekonstrukcí denzitních obrazů.
Lineární urychlovač po přepnutí do výkonového „high dose“ režimu rotuje kolem pacienta a ozařuje cílovou tkáň, lokalizovanou v předchozím diagnostickém CT kroku. Toto ozařování přitom může probíhat s modulovaným svazkem za použití bipolárního kolimátoru MLC, pro různé úhly může být intenzita -svazku větší či menší (popř. záření zcela vypnuto), či svazek vhodně tvarován tak, aby se dávka záření vyhýbala kritickým tkáním. Stejně jako v předchozím kroku, spolu s rotací urychlovače a detektorů se automaticky posouvá i lehátko s pacientem.
Výhody tomoterapie:
- Menší nároky na prostory (stavební úspory)
- Nižší požadavky na stínění (stínicí bloky součástí přístroje)
- On – line zobrazování pro adaptaci ozařovacích plánů
- Diferenciální ozařování
Nevýhody tomoterapie:
- MVCT – nižší kvalita oproti CBCT
- Vyšší radiační zátěž v rámci procesu verifikace
Tomoterapie využívá verifikační MVCT denně před vlastním ozářením. MVCT spočívá v 200° rotaci zdroje záření a detektoru. Přestože systém využívá poměrně nízkých dávek pomocí low dose beam MVCT, dávka na jednu verifikaci pro oblast hlavy a krku se pohybuje okolo 15 cGy. Kvalita zobrazení pomocí MVCT je závislá na použitých MU (s rostoucí hodnotou MU stoupá kvalita obrazu a zároveň se navyšuje dávka).
[sgmb id=“1″]