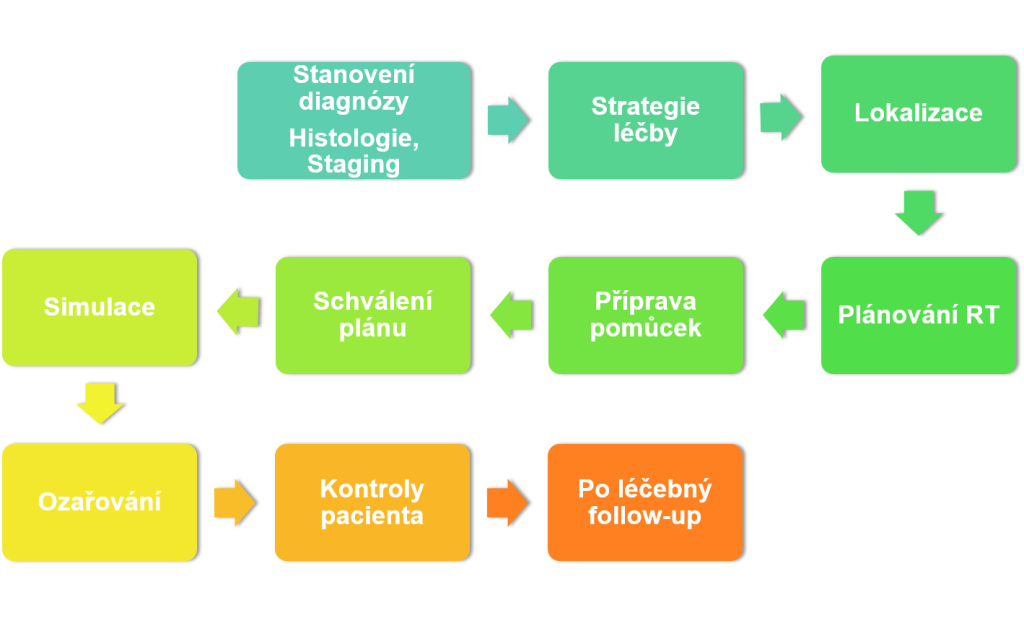
Radioterapie
Radioterapie je klinický obor, který využívá účinky ionizujícího záření v léčbě maligních i benigních tumorů, a to jak samostatně, tak v kombinaci s dalšími léčebnými metodami. Těmi mohou být např.: chemoterapie, imunoterapie, biologická léčba apod. Cílem radioterapie je především aplikace přesně definované dávky záření do cílového objemu v těle pacienta za současného šetření zdravé tkáně v co největším rozsahu.
Radioterapie v praxi
Histologie a staging
Ke stanovení rozsahu onemocnění je třeba provést tzv. Staging, což je rozlišení stadia nemoci. V ČR se pro tyto účely provádí tzv. TNM klasifikace.
T – rozsah primárního nádoru, T1 – 4, T0, TX
N – stav regionálních mízních uzlin
M – (ne)přítomnost vzdálených metastáz, M0, M1, MX
TNM klasifikace se hodnotí několika způsoby. Klinická klasifikace vychází
z hodnocení z klinického vyšetření a je značena předřazením písmene c. Patologická klasifikace s předřazením písmene p vychází ze závěru patologa, který provedl histopatologické vyšetření vzorku získaného buď biopticky, nebo během operace. Oba stupně, klinický i patologický, užívají stejného hodnocení T, avšak kategorie T1 je určována pouze klinicky.
Americká literatura rovněž uvádí speciální klasifikační stupně pro případy
re-stagingu post (neoadjuvantní) léčby (y), re-iradiace (r) a pitvy (a). (Rodrigues, 2013) Nejrozšířenější americký staging sytém je od roku 1995 rovněž založen na TNM klasifikaci. Nazývá se „The AJCC TNM staging system“ a v současné době pracuje mimo výše uvedené klíčové informace s dvěma typy stupňů – klinickým a patologickým stupněm – stejně jako Česká republika.
Klasifikovaná stádia pak dělíme do čtyř skupin:
- Stadium I. – lokální růst, bez diseminace onemocnění
- Stadium II. – rozsáhlý lokální růst bez diseminace nebo minimální růst s počínající regionální diseminací
- Stadium III. – rozsáhlé lokální a regionální postižení bez vzdálené diseminace
- Stadium IV. – lokální přerůstání do okolních struktur, nebo i při malém postižení tvorba vzdálených metastáz
V okamžiku, kdy známe staging pacienta, můžeme rozhodnout o strategii léčby.
Strategie léčby
KURATIVNÍ LÉČBA
Cílem kurativní léčby je úplně vyléčení pacienta i za cenu zhoršení kvality jeho života (pozdní nežádoucí účinky, ztráta chuti, nutnost stomie, reakce kůže na ozáření apod.) Nežádoucí účinky radioterapie plynou z její podstaty, pro jejich minimalizaci se tak indikuje maximální dávka, která je spojena s přijatelnou mírou těchto komplikací (zpravidla < 5 %). Kurativní léčba se velmi často kombinuje s dalšími terapeutickými metodami (chemoterapie, imunoterapie, biologická léčba, hormonální terapie, chirurgický zákrok,…) V posledních letech se lékaři snaží neinvazivní radioterapií nahradit komplikované chirurgické zákroky.
PALIATIVNÍ LÉČBA
Cílem paliativní léčby je prevence vzniku komplikací (bolesti, krvácení) či jejich zmírnění a léčba v případě, že již nastaly. Paliativní radioterapie může zvýšit kvalitu života (může působit analgeticky), může život dokonce prodloužit, jejím cílem však není pacienta vyléčit úplně. Paliativní léčba se od kurativní liší především ve frakcionaci.
Před samotným začátkem plánování radioterapie lékař informuje pacienta o všech aspektech léčby způsobem, který je přiměřený jeho stavu, intelektu či emočnímu rozpoložení a nechá jej rozhodnout, zda s léčebným postupem souhlasí. Dle platné české legislativy musí být vždy součástí karty pacienta informovaný souhlas. Lékař si rovněž ověří, zda pacient jednotlivým termínům porozuměl a je tedy plně informován o svém stavu i možnostech terapie. Tento proces může někdy trvat i několik dnů, každý pacient musí mít dostatek času na své rozhodnutí. Při podání všech informací může dojít k dezorientaci a pacient se tak může cítit zahlcen.
Lokalizace cílového objemu a kritických orgánů
K lokalizaci cílového objemu a kritických orgánů nám slouží fixační pomůcky, referenční izocentrum a z přístrojové techniky simulátor a CT. Úkolem radiologického asistenta je především připravit vhodnou polohu pro ozařování. Ozařovací poloha by měla být v rámci možností pohodlná, abychom zamezili interfrakčním i intrafrakčním pohybům pacienta. K zajištění ozařovací polohy využívá dle zvyklostí a vybavení pracoviště vhodné fixační pomůcky s ohledem na diagnózu. Fixační pomůcky mohou být nastavitelné, v tom případě se zaznamená individuální nastavení pro konkrétního pacienta, neboť pomůcku používá více pacientů, nebo individuální, kdy je pomůcka vyrobena pacientovi přímo na míru na celou dobu ozařování. Mezi nejpoužívanější fixační pomůcky řadíme vakuové podložky, pánevní a hlavové masky, breastboardy, podložky trupu i nohou.
Po znehybnění pacienta pomocí fixačních pomůcek zaznačíme na kůži orientační značky, tzv. „nulové body“, do jejichž středu se na některých pracovištích vkládá kontrastní marker (brok). Pro zakreslení těchto značek se využívají speciální dlouhotrvající barvy, zpravidla zelené a červené. (Jejich aplikace závisí na zvyklostech daného pracoviště.) Značky na kůži zakreslujeme podle laserového pozičního systému. Lasery jsou umístěny na stěně ve třech rovinách (axiální, sagitální a koronární) a protínají se v tzv. izocentru.
Plánovací CT
Po zakreslení orientačních značek odchází pacient na plánovací CT (některá pracoviště mají k dispozici CT simulátor.) Pro plánovací CT vyšetření však může být použito běžné CT, neboť jediný rozdíl oproti diagnostickému vyšetření spočívá v uložení pacienta do ozařovací polohy. Pro tyto účely se opět využijí fixační pomůcky a laserový poziční systém. V CT snímcích se provedou tzv. konturace pro zakreslení kritických orgánů (OAR – Organs at Risk) a zakreslí se nádor (GTV, CTV) a cílový objem (PTV).
V některých případech (měkké tkáně, nervy, stejná denzita PTV a OAR) se indikuje také MRI, PET/CT, SPECT/CT nebo fMRI.
Plánování radioterapie
Na plánování léčby se podílí lékař spolu s radiačním fyzikem či radiologickým asistentem. Plánování je založeno na optimalizaci požadavků v aplikaci dávky a šetření okolní tkáně. Lékař si na plánovací konzole vyznačí na vybraných CT skenech ve všech třech anatomických rovinách (sagitální, koronální, transverzální rovina) kontury cílového objemu a kritických orgánů, a díky speciálního programu stanoví uložení izocentra vůči „nulovému bodu“. Výsledné odchylky referenčního bodu a izocentra, stanovené opět ve všech třech anatomických rovinách, souží pro následující simulaci. Ozařovací technika se volí podle vhodné dávkové distribuce, k modifikaci svazku záření slouží klínové filtry. Kompenzační filtry upravují nehomogenitu dávkové distribuce při nerovném povrchu nebo při různé hloubce uložení cílového objemu. K vykrývání části pole se používají klasické stínicí bloky nebo vícelamelový kolimátor (MLC – multileaf collimator). Dávka záření se specifikuje podle doporučení ICRU 50 do izocentra, které má být lokalizováno přibližně uprostřed cílového objemu. Dávka v izocentru je normalizována na hodnotu 100%, kolísání dávky v plánovacím cílovém objemu by se mělo pohybovat v rozmezí 95–107%. Místa s dávkou vyšší jak 100% se označují hot spots, v cílovém ojemu by jich nemělo být příliš kvůli neúměrnému navýšení dávky a vzniku tkáňové nekrózy.
Optimalizace plánu se provádí podle objemových histogramů (DVH – dose volume histogram). Křivky demonstrují objemovou expozici plánovaného cílového objemu a kritických orgánů. Systém umožňuje porovnání DVH pro různé ozařovací techniky s následným výběrem nejvhodnější modality. (Binarová, 2010)
Vyjma fyzikální stránky se zohledňuje také věk a celkový stav pacienta, strategie léčby, předchozí léčba či kombinace s dalšími léčebnými metodami.
Simulace
Na simulátoru je následně zakresleno plánovací izocentrum. Pro ozařování je vždy směrodatné izocentrum naplánované na podkladě plánovacího CT, nikoli lokalizační značky! Lokalizační značky nám slouží pro reprodukovatelnost ozařovací polohy, izocentrum k přesnému ozařování PTV.
Úlohou simulátoru je pořízení verifikačních snímků (nebo DRR), verifikace tvaru polí a také kontrola geometrických kolizí.
Vzdálenost zdroje (ohniska) na gantry lineárního urychlovače od izocentra je zpravidla 100 cm. Značí se SAD – Source Axis Distance. Co se však u každého pacienta liší je SSD – Source Skin Distance, protože tělesná stavba pacientů je rozdílná. SSD se vypočítává plánovacím systémem. Druh zaměřování (SAD nebo SSD) se liší na jednotlivých pracovištích i u jednotlivých pacientů v rámci pracoviště. Rozdílná tělesná stavba pacientů, stranová lokalizace nádoru nebo technická omezení ozařovny by mohly způsobit kolizi gantry s pacientem. Simulátor má za úkol zjistit, zda je plán realizovatelný ze všech úhlů. Další kontrolu pro prevenci kolize provádí radiologický asistent při prvním nastavení na ozařovně, na některých pracovištích za přítomnosti lékaře či fyzika, který plán vypracoval.
Pokud se na simulátoru zjistí, že úhel ozáření je možné použít, ale není možné k němu dojet bez zásahu radiologického asistenta, poznamená se tato skutečnost do dokumentace. Radiologický asistent si následně může vypomoci posunem stolu a po nastavení gantry jeho návratem do původní polohy, sejmutím klínů po sobu přejezdu či zasunutí ližin (lišt) na ozařovacím stole.
Ozařování
Po proběhnutí plánovacího postupu je pacient odeslán na ozařovny, kde je objednán k prvnímu nastavení dle kapacity pracoviště. Při ozařování se na prvním místě provádí identifikace pacienta. Podle zvyklosti se pacient vždy představí jménem a uvede datum narození, případně se prokáže osobním průkazem, jedná-li se o pacienta např. v umělém spánku nebo z jiného důvodu neschopného se identifikovat, provedeme důslednou kontrolu identifikačního náramku. Prvnímu nastavení je vždy přítomen lékař. Pacientovi vysvětlíme, jak bude ozařování probíhat, seznámíme ho s pravidly pracoviště (pravidelný čas ozařování, odkládání oděvů a bot, vlastní ručník, vyjmutí zubní protézy apod.), a provedeme edukaci k péči o ozařovanou kůži.
Jednotlivá pracoviště mají různé způsoby práce, nelze tedy říci, který je ten jediný správný. Vždy se držíme zavedeného postupu a jakékoli odchylky ihned hlásíme kolegům a kolegyním, případně i ošetřujícímu lékaři pacienta. V radiační onkologii je komunikace personálu velice důležitá, neboť některé chyby mohou být pro pacienta fatální.
Následná péče a sledování
Postradiační péči si zajišťují lékaři sami. Radiologický asistent by se v případě správného postupu práce a samozřejmě při účinkující terapii již neměl s pacientem, který ukončil radioterapii, setkat. Často se však stává, že se spokojený pacient zastaví na ozařovně a pozdraví radiologické asistenty. Je to velmi milý projev vztahu, který se Vám s pacientem povede navázat.
Radioterapie je zpravidla dlouhodobá záležitost, pacienta vídáme denně a budujeme si tak pouto. Empatický radiologický asistent si pamatuje své pacienty, nikdy neopomene „prohodit několik slov“ nad rámec své povinnosti a vlastně takto přispívá k psychické pohodě pacienta. S nabytou praxí radiologičtí asistenti snáze dovedou rozlišovat kritické okamžiky a povolat k pacientovi ošetřujícího lékaře případně klinického psychologa. Radiologický asistent, který pracuje v oboru radiační onkologie, se pro pacienty na několik týdnů stává jakýmsi průvodcem a nezřídka i přítelem. Pacienti si často i mnoho let pamatují naše tváře a chování. Základním pravidlem pro radiologické asistenty z radioterapie by mělo být: „Za každých okolností se chovej k lidem tak, jak bys sám chtěl, aby se k tobě choval zdravotnický personál, kdybys byl nemocný.“
Zdroj: BINAROVÁ, Andrea. Radioterapie. Ostrava: Ostravská univerzita v Ostravě, Fakulta zdravotnických studií, 2010. ISBN 978-80-7368-701-4
www.linkos.cz